|
№ |
тақырыбы |
Оқу мақсаты |
|
|
№1 зертханалық тәжірибе «Атомдар модельдерін жасау» |
8.1.3.3-s және p орбиталдарының пішінін білу; |
|
|
№ 2 зертханалық тәжірибе«Әрекеттесуші заттардың қатынасы» |
8.2.3.3-реакцияға қатысатын және түзілетін заттардың формуласын жаза отырып, химиялық реакциялар теңдеулерін құру; |
|
|
№3 зертханалық тәжірибе «Металдардың қышқылдар ерітінділерімен әрекеттесуі» |
8.2.4.5–металдардың қышқылдармен әрекеттесуінің реакция теңдеулерін құрастыру |
|
|
№4 зертханалық тәжірибе «Энергияның өзгеруімен жүретін химиялық реакциялар» |
8.3.1.3–экзотермиялық реакциялар жылу бөле жүретінін, ал эндотермиялық реакциялар жылу сіңіре жүретінін білу; |
|
|
№5 зертханалық тәжірибе «Заттардың ерігіштігін зерттеу» |
8.3.4.1–заттарды судағы ерігіштігі бойынша жіктеу; |
|
|
№6 зертханалық тәжірибе «Оксидтердің қасиеттерін зерттеу» |
8.3.4.7–оксидтердің жіктелуін және қасиеттерін білу, олардың химиялық қасиеттерін сипаттайтын реакция теңдеулерін құрастыру |
|
|
№ 7 зертханалық тәжірибе «Қышқылдардың қасиеттерін зерттеу» |
8.3.4.8–қышқылдардың жіктелуін, қасиеттерін білу және түсіну, олардың химиялық қасиеттерін сипаттайтын реакция теңдеулерін құрастыру |
|
|
№ 8 зертханалық тәжірибе «Негіздердің қасиеттерін зерттеу» |
8.3.4.9–негіздердің жіктелуі мен қасиеттерін білу және түсіну, олардың химиялық қасиеттерін сипаттайтын реакция теңдеулерін құрастыру |
|
|
№ 9 зертханалық тәжірибе «Тұздардың алынуы» |
8.3.4.11–тұздардың қасиеттерін, жіктелуін білу және түсіну, олардың химиялық қасиеттерін сипаттайтын реакция теңдеулерін құрастыру |
|
|
№ 10 зертханалық тәжірибе «Судың кермектігін анықтау» |
8.4.2.9–судың «кермектігін» анықтау және оны жою тәсілдерін түсіндіру; 8.4.2.10–судың мыс (II) сульфатын қолданып анықтау тәсілін білу |
Химиялық тәжірибе жасау барысында қауіпсіздік техникасын көрсететін белгілер

Заттарды қолмен ұстауға тыйым салынады
Реактивтер құйылған ыдыстарды ашық қалдыруға тыйым салынады
Күйдіргіш зат – қышқыл! Теріні күйдіреді, тітіркендіреді.
Күйдіргіш зат – сілті! Теріні күйдіреді, тірікендіреді.
Улы және физиологияға қатерлі заттар.
Улы және физиологияға қатерлі заттар.
Улы және физиологияға қатерлі заттар.
Теріге тиген қышқыл ерітіндісін судың қатты ағысында жуып, 2%-дық ас содасының ерітіндісімен шайыңыз


Теріге тиген сілті ерітіндісін судың қатты ағысында жуып, 2%-дық ас содасының ерітіндісімен шайыңыз
Заттың иісін білу үшін ыдысқа қатты еңкеймей, тек газды қолмен желпіп қана иісін көру қажет
Тұрғыға сынауықты мойын жағынан бекіту қажет
Спиртшамын шырпымен жағып, спиртшамның қалпағымен сөндіру қажет
Сынауықты алдымен бүкіл бойын қыздырып, одан кейін зат тұрған жерді қыздыру қажет
Затты жалынның ең жоғарғы нүктесінде қыздыру қажет, себебі ол ең ыстық бөлігі
Қыздыруға арналған ыдыстарды (фарфор табақша, металлдан, шыныдан және фарфордан жасалған пластинкаларды) тигельді қысырғыштармен ұстау қажет
Қатты заттар үшін шпатель пайдалану керек
Сынауықта заттарды араластыру үшін қаттырақ шайқау қажет
Химиялық стақандағы затты араластыру үшін ұшына резеңке тығын тығылған шыны таяқшамен араластыру қажет
ҚТ ережесімен таныстым ——————————————-
Күні « » Зертханалық жұмыс № 1
Тақырыбы: Атомдар модельдерін жасау.
Мақсаты: Атомдар модельдерін жасап үйрену.
Құрал – жабдықтар: әртүрлі ермек саз, дайын шарстержн немесе сіріңке шиі.
Модель құрған кезде осы элементтердің түсі ермексазға сәйке келетін болсын.
Ермексаздан және металдан немесе пластмассадан жасалған шарлар мен таяқшалар берілген. Мұғалімнің тапсырмасы бойынша: заттардың моделдерін жасаңдар.
|
Жұмыстың барысы:
|
Не байқалды |
Қортынды, жасаған модельдің суретін салу. |
|
Сутектің – түссіз газ ақ түсті Судың модельі H2O |
|
|
|
Көміртек- қара түсті CO2 |
|
|
|
Күкірттің- сары түсті H2S |
|
|
|
Иодтың- қызыл-қоңыр HI |
|
|
|
Оттек- көгілдір O2 |
|
|
|
Темір- қара сұр Fe2O3 |
|
|
Қортынды:—————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————-
Күні « » Зертханалық жұмыс №2
Тақырыбы: Әрекеттесуші заттардың қатынасы.
Мақсаты: Әрекеттесіші заттардың жағдайда қатынасын тәжірибе жүзінде анықтап, құрам тұрақтылығы заңының дұрыстығын және зат массасының сақталу заңын дәлелдеу.
Реактивтер мен құрал-жабдықтар: Мыс сульфатының ертіндісі, натрий гидроксиді, бюретка, сынауық, сызғыш, тұрғы.
Жұмыстың барысы. І нұсқа:
|
нұсқау |
Не байқалды |
Қортынды. Реакция теңдеуі |
|
Барлық сынауықтарға (7дана) 5 мл–ден Натрий гидроксдінің ертіндісін құйыңдар. Бюретканың көмегімен мына ретпен 1мл 1,5мл 2мл 2,5мл 3 мл 3,5 мл 4мл әр сынауққа әр түрлі көлемде мыс сульфатының ертіндісін құйыңдар. Біраз уақыт өткен соң кейбір сынауықта тұнба тзіледі. Сызғыштың көмегімен тұнбаның биіктігін өлшеңдер. |
|
|
Кестегі толтырыңдар.
|
№ |
Натрий гидроксиді |
Мыс сульфаты |
Тұнбаның биіктігі |
|
|
5 мл |
1мл |
|
|
|
5 мл |
1,5мл |
|
|
|
5 мл |
2мл |
|
|
|
5 мл |
2,5мл |
|
|
|
5 мл |
3 мл |
|
|
|
5 мл |
3,5 мл |
|
|
|
5 мл |
4мл |
|
ІІ нұсқа:
Мақсаты: Тәжірибе жүзінде әрекеттесуші заттардың массаларының қатынасын анықтау.
Реактивтер мен құрал- жабдықтар: Темір ұнтағы, кристалдық күкірт, қасық, техникалық таразы, сағат шынысы, спирт шамы, сіріңке, тұрғы, кәрлен табақша, шыны таяқша , спирт шам.
|
Жұмыстың барысы:
|
Не байқалды? |
Қортынды, реакция теңдеуі |
|
Темірдің әрекеттесу теңдеуін жазып, заттардың қатынасын анықтаңдар. |
|
|
|
Темір мен күкірттің физикалық қасиеттерін анықтаңдар және суға салып араластырыңдар. |
|
|
|
Реагентті үнемдеу үшін реакция тез жүру үшін ең аз мөлшерін аламыз. Техникалық таразыға темір мен күкіртті өлшеп алыңдар. Тұрғыға кәрлен табақшаны бекітіп алып, өлшеп алған темір мен Күкірт қоспасын шыны таяқшасымен араластыра отырып спирт шамның жалынында қыздырыңдар. |
|
|
|
Бұл тәжірибе көмегімен қай заңның дұрыстығын дәлелдеуге болады. |
|
|
Қортынды:—————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————-
Күні « » Зертханалық жұмыс № 3
Тақырыбы: Металдардың қышқылдар ертіндісімен әрекеттесуі.
Мақсаты: Әртүрлі металдардың қышқыл ертінділерімен әрекеттесуін зерттеу. Химиялық инертті металдар болатындығы туралы тұжырымдама жасау.
Құрал-жабдықтар мен реактивтер: Сынауқтар, Металдар; магний, мырыш, темір, мыс, Тұз қышқылы және фосфор қышқылы.
|
Жұмыстың барысы |
Не байқалды? |
Қортынды р.т жазу |
|
Төрт сынауыққа бірдей тұз қышқылын құйып оған металдарды салыңдар: 1- шісынауық Магний ұнтағын 2- шісынауық Мырыш түйірін, 3- шісынауық Темір ұнтағын, 4- шісынауық Мыс сымын
|
|
|
|
Төрт сынауыққа бірдей фосфор қышқылын құйып оған металдарды салыңдар: 1- шісынауық Магний ұнтағын 2- шісынауық Мырыш түйірін, 3- шісынауық Темір ұнтағын, 4 — шісынауық Мыс сымын
|
|
|
Қортынды:—————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————-
Күні « » Зертханалық жұмыс № 4
Тақырыбы: Энергияның өзгеруімен жүретін химиялық реакциялар.
Мақсаты: реакциялардың жылуды бөле немесе сіңіре жүретінін білу.
Құрал- жабдықтар мен реакивтер: натрий гидроксиді, тұз қышқылы, ыс гидроксиді жаңадан дайындалған. Сынауықтар, ұстағыштар, спирт шамы, сіріңке, термомерт, химиялық стақан, цилиндр, шыны таяқша.
Жұмыстың барысы:
|
Жұмыстың жүру реті |
Не байқалды? |
Қортынды. Реакция теңдеуі. |
|
Жылу бөле жүретін реакция: Целиндрге мл натрий гидроксидін және тұз қышқылын өлшеп алыңдар,. Құрғақ стақанға ертіндіні құйып Алып термомертмен оның температурасын өлшеңдер. Осы Стақанға екінші цилиндрдегі ертіндіні тездетіп құйып, шыны таяқшамен Абайлап араластыра отырып ең жоғарғы температураның мәнін жазыңдар. |
|
|
|
Жылу сіңіре жүретін реакциялар. Сынауққа жаңа дайындалған мыс гидроксидінің тұнбасын құйыңдар. Сынауықты ұстағашта бекітіп, қт ережесін сақтай отырып спирт шамын жағып сынауықты қыздырыңдар. |
|
|
Қортынды:————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————
Күні « » Зертханалық жұмыс № 5
Тақырыбы: Заттардың ерігіштігін зерттеу.
Мақсаты: Әр түрлі заттардың ерігіштігін зерттеңдер.
Құрал- жабдықтар мен реактивтер: Жаңа әзірленген әк суы, кальций хлориді, кальций карбонаты, Химиялық стақан, шыны таяқша, дистилденген су, өлшеуіш цилиндр.
|
Жұмыстың барыс:
|
Не байқалды? |
Қортынды, реакция теңдеуі. |
|
Үш химиялық стақанға цилиндрдің көмегімен белгілі көлемде дист су құямыз. Берілген заттарды суда ерігіштігін сынаңдар, шыны таяқшамен араластырыңдар. |
|
|
|
әк суы Ca(OH)2 |
|
|
|
кальций хлориді Ca Cl2 |
|
|
|
кальций карбонаты CaCO3 |
|
|
Қортынды:————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————
Күні « » Зертханалық жұмыс № 6
Тақырыбы: Оксидтердің қасиеттерін зерттеу.
Мақсаты: Оксидтердің жіктелуі мен қасиеттерін білу және түсіну.
Реактивтер мен құрал-жабдықтар: Сөндірілмеген әк СаО, Қызыл фосфор Р, Индикатор, дист су, кәрлен атбақша, сынауықтар, темір қысқыш, спирт шам, сіріңке, конустық колба.
|
Жұмыстың барыс |
Не байқалды? |
Қортынды ,р.т жазу. |
|
Кальций оксидімен : Кәрден табақшаға сөндірілмеген әк салып, оған жайлап су құйыңдар. Реакция жүре ме? Біраз тұндырып ертіндіні құйып алыңдар, оны екі сынауыққа бөліп құйып индикатормен сынаңдар. Не байқалды? |
|
|
|
Фосфор оксидімен: Темір қасықпен қызыл фосфорды алып, спирт шамның жалынында ұстаңдар. Фосфор От алған кезде конусты колбаға салыңдар. Колба фосфор оксдіне ақ бументолады, оған біраз дист су құйып араластырыңдар, ертіндіні екіге бөліп индикатормен сынаңдар. |
|
|
Қортынды:————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————
Күні « » Зертханалық жұмыс № 7
Тақырыбы: Қышқылдардың қасиеттерін зерттеу.
Жұмыстың мақсаты: қышқылдардың құрамы мен қасиеттерін білу және түсіну.
Құралдар мен реактивтер:Штатив, сынауықтар, индикаторлар:лакмус, фенолфталеин, метилоранж; ортофосфор қышқылы, тұз қышқылы, азот қышқылы, мыс, мырыш,темір, темір оксиді (ІІ), мыс оксиді (ІІ). Күміс нитраты.
|
Тәжірибе |
Берілген заттар |
Реакция белгілері |
Реакция теңдеу лері |
|
Қышқылдардың индикаторға әсері |
Лакмус, тұз қышқылы |
|
|
|
Фенолфталеи, тұз қышқылы |
|
|
|
|
Метилоранж, тұз қышқылы |
|
|
|
|
Қышқылдардың металдарға әсері |
Темір, тұз қышқылы |
|
|
|
Мырыш, тұз қышқылы |
|
|
|
|
Мыс, тұз қышқылы |
|
|
|
|
Қышқылдар мен металдардың оксидтерімен әрекеттесуі |
Мыс оксиді, тұз қышқылы |
|
|
|
Темір(ІІ) оксиді, тұз қышқылы |
|
|
|
|
Қышқылдар мен тұздармен әрекеттесуі. |
Тұз қышқылына күміс нитратын қосыңдар |
|
|
Күні « » Зертханалық жұмыс № 8
Тақырыбы: Негіздердің химиялық қасиеттерін зерттеу.
Жұмыстың мақсаты: негіздердің химиялық қасиеттерін зерттеу.
Құралдар мен реактивтеp:.Сынауықтар,штатив,шыны таяқша, спиртшам,химиялық стақандар, сіріңке, қысқыш, кәрлен табақша; натрий, кальций, мыс(ІІ), темір(ІІІ)гидроксидтері ,су, фенолфталеин, тұз қышқылы, мыс сульфаты, кальций оксиді.
Жұмыстың тәртібі:
Тапсырма 1.Берілген негіздердің физикалық қасиеттерін сипаттау.
|
Негіздер |
Суда ерігіштігі |
Түсі |
Агрегаттық күйі |
фенолфталеин түсі |
|
Кальций гидроксидіCa(OH)2 |
|
|
|
|
|
Натрий гидроксидіNaOH |
|
|
|
|
|
Мыс(ІІ) гидроксиді Cu(OH)2 |
|
|
|
|
|
Темір(ІІІ)гидроксиді Fe(OH)3 |
|
|
|
|
Тапсырма 2.
|
Тәжірибе |
Реакция белгілері |
Реакция теңдеулері |
|
Сілті ертіндісімен қышқыл ертіндісіне әсері. Сынауыққа тұз қышқылы ертіндісін құйып оған метилоранж тамызыңдар. Ертіндінің түсі өзергенше бюреткадан натрий гидроксидін тамшылатып құйыңдар. |
|
|
|
Сілті ертіндісіне тұз ертіндісінің әсері. Сынауыққа мыс сульфатын ертіндісін құйып оған тұнба түзілгенше натрий гидроксидінің ерітіндісіне құыңдар |
|
|
|
Кәрлен табақшаға мыс (ІІ) гидроксидін салып спирт шамына қыздырыңдар.. |
|
|
Қорытынды———————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————
Күні « » Зертханалық жұмыс№ 9
Тақырыбы: Тұздардың қасиеттері және алынуын зерттеу.
Жұмыстың мақсаты: Химиялық реакциялардың нәтижесінде тұздардың қасиеттерін зерттеу.
Құралдар мен реактивтер: Сынауықтар,тамшуыр,барий хлориді,күкірт қышқылы,азот қышқылы,мыс сульфаты, темір (ІІІ) хлориді,натрий гидроксиді,күміс нитраты,натрий сульфаты.
Жұмыстың тәртібі:
|
Тәжірибе |
Берілген заттар |
Реакция белгілері |
Реакция теңдеулері |
|
Тұздардың қышқылдармен әрекеттесуі
|
Барий хлориді,күкірт қышқылы |
|
|
|
Барий хлориді,азот қышқылы |
|
|
|
|
Сілтілердің тұздармен әрекеттесуі |
Мыс сульфаты,натрий гидроксиді |
|
|
|
Темір (ІІІ) хлориді,натрий гидроксиді |
|
|
|
|
Тұздың тұзбен әрекеттесуі
|
Барий хлориді,күміс нитраты |
|
|
|
Барий хлориді,натрий сульфаты |
|
|
Күні « » Зертханалық жұмыс №10
Тақырыбы: Судың кермектігін анықтау.
Мақсаты: Судың кермектігін анықтау және оны жою тәсілдерін түсіндіру.
Реактивтер мен құрал-жабдықтар; Су, натрий карбонатының ертіндісі. Сынауықтар.
|
Жұмыстың орындауы |
Не байқалды? |
Қортынды. |
|
Екі сынауыққа құдықтан немесе кұбырдан алынған су құйыңдар. Бір сынауықтағын спирт шамына апарып қайнатыңдар.
|
|
|
|
Екінші сынауыққа натрий корбанатын ертіндісін құйыңдар .Не байқалды?
|
|
|
Қортынды : ————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————
Сарамандық жұмыстар
|
№ |
тақырыбы |
Оқу мақсаты |
|
|
№1 практикалық жұмыс «Металдар дың белсенділігін салыстыру |
8.2.4.8–металдардың белсенділік қатарын қолданып металдардың таныс емес орынбасу реакцияларының жүру мүмкіндігін болжау |
|
|
№2 практикалық жұмыс «Сутекті алу және оның қасиеттерін тану» |
8.4.2.1–сутекті алу және оның қасиеттері мен қолданылуын зерттеу |
|
|
№3 практикалық жұмыс «Оттекті алу және оның қасиеттерін тану» |
8.4.2.3–оттекті алу және оның қасиеттері мен қолданылуын зерттеу |
|
|
№4 практикалық жұмыс «Қатты заттардың ерігіштігіне температураның әсері» |
8.3.4.4–буландыру техникасын қолдана отырып, заттың 100 г судағы ерігіштігін есептеу, алынған нәтижелерді анықтамалық мәндермен салыстыру |
|
|
№5 практикалық жұмыс «Пайыздық және молярлық концентрациялары берілген ерітінді лерді дайындау» |
8.3.4.6–ерітіндідегі заттың молярлық концентрациясын есептеу |
|
|
№ 6 практикалық жұмыс «Көміртектің физикалық және химиялық қасиеттері». |
8.4.3.5–көміртектің физикалық және химиялық қасиеттерін зерттеу; |
|
|
№ 7 практикалық жұмыс «Көмірқышқыл газын алу және оның қасиеттерін зерттеу» |
8.4.3.7–көмірқышқыл газын ала алу, оны анықтау және қасиеттерін зерттеу; |
Күні « »
№1 практикалық жұмыс «Металдардың белсенділігін салыстыру.
Мақсаты: нәтижелерді қортындылап металдардың белсенділік қатарын құру.
Реактивтер мен құрал- жабдықтар: Петри табақшалары, сынауықтар, металдар; мыс жаңқасы, қалайы мен темір жаңқалары, қорғасын түйіршігі, Қалайы тұздарының ертіндісі, мыс сульфаты, темір хлориді, мырыш сульфаты, қалайы хлориді, қорғасын нитраты.
Жұмыстың барысы:
|
Жұмыстың орындау тәртібі |
Не байқалды? |
Қортынды Р.Т жазыңдар |
|
Бес сынауыққа тұздардың ертіндісін құйыңдар да, олардың әрқайсысына мыс жаңқаларын салыңдар. Осы тәжірибені қалған металдармен қайталаңдар. |
CuSO4 FeCl3 ZnSO4 Sn Cl3 PbNO3 |
CuSO4 + Cu = FeCl3 + Cu = ZnSO4 + Cu = Sn Cl3 + Cu = PbNO3 + Cu = |
|
CuSO4 FeCl3 ZnSO4 Sn Cl3 PbNO3 |
CuSO4 + Fe = FeCl3 + Fe = ZnSO4 + Fe = Sn Cl3 + Fe = PbNO3 + Fe = |
|
|
CuSO4 FeCl3 ZnSO4 Sn Cl3 PbNO3 |
CuSO4 + Zn = FeCl3 + Zn = ZnSO4 + Zn = Sn Cl3 + Zn = PbNO3 + Zn = |
|
|
CuSO4 FeCl3 ZnSO4 Sn Cl3 PbNO3 |
CuSO4 + Sn = FeCl3 + Sn = ZnSO4 + Sn = Sn Cl3 + Sn = PbNO3 + Sn = |
|
|
CuSO4 FeCl3 ZnSO4 Sn Cl3 PbNO3 |
CuSO4 + Pb = FeCl3 + Pb = ZnSO4 + Pb = Sn Cl3 + Pb = PbNO3 + Pb = |
Қортынды. Металдардың белсенділік қатарын құрыңдар;—————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————
Күні « »
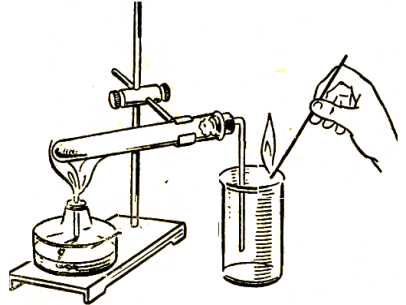
№2 практикалық жұмыс «Сутекті алу және оның қасиеттерін тану»
Мақсаты: сутек газын алу, оның тотықсыздандырғыштық қасиетін білу.
Құрал-жабдықтар мен реактивтер: сутек газын алатын қарапайым құрал, тұрғы, сынауықтар, спиртшам, сіріңке, қысқыш, мырыш түйірлері, 30%-дық тұз қышқылы ерітіндісі.
ҚТ:


ҚТ ережелерімен таныстым________________
Жұмыстың барысы:
|
Не істеу керек? |
Не байқадым? |
Реакция теңдеулері. Қорытынды |
|
Суреттегідей сутек алатын қондырғы даярлау Сынауыққа 4-5 түйір мырыш салып, металл тұрғыға орналастыру. Үстінен сынауықтың ¼ бөлігіне келтіріп тұз қышқылынан құю. Екінші сынауықтың аузын төмен қаратып сутек газын жинау, сутектің тазалығын тексеру. Бөлініп жатқан сутекті жағу
|
__________________________________________ |
1.Сутекті алу реакциясын жазыңдар: Zn + HCl →____+ _____ Бұл реакция қай типке жатады?_________ _______________________ Сутек газын не себепті төңкерілген сынауыққа жинайды? _______________________ _______________________ _______________________
2.Сутектің жану реакциясын құрастырыңдар: H2 + O2→____ Бұл реакция қай типке жатады?________ _______________________
|
Қорытынды: ________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Күні « »
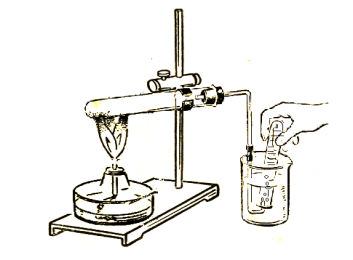
№3 практикалық жұмыс «Оттекті алу және оның қасиеттерін тану»
Мақсаты: оқушылар жұмысты өздері орындайды, оттек газын алып оның қасиеттерін зерттейді.Оттегінің тотықтырғыштық қасиетін білу.
Құрал-жабдықтар мен реактивтер: газ алатын құрал, тұрғы, газ жинайтын стакан немесе сынауық, ұстағыш, сіріңке, спиртшам, марганец (ІV) оксиді, сутек пероксиді магний тасы, индикатор күкірт.



ҚТ ережелерімен таныстым________________
Жұмыстың барысы:
|
Жұмыстың орындалысы
|
Не көрдің? Қажетті заттардың суреті. |
Қорытындысын және тиісті реакция теңдеулерін жаз. |
|
Оттегін алу және жинау; Оттекті алуға қажетті құрылғы құрастыру. Құрылғының герметикалығын тексеру . |
|
—————————————— —————————————— —————————————— —————————————— ——————————————— |
|
Оттекті алу: Сынауыққа аздап сутектің асқын тотығын сынауыққа құйып катализатор марганец оксидін салып, қыздырыңдар және оттегі бар екендігін дәлелдеу. |
|
——————————————- ——————————————- ——————————————— —————————————— —————————————— ——————————————- ——————————————- |
|
Оттекті жинау; Ауа ығыстыру арқылы, Судың астында. |
|
——————————————- ——————————————- ——————————————— ——————————————
|
|
Оттектің химиялық қасиеті: Күкірт оттекте жануы Және жанып болған сынауыққа су құйып ауызын жауып жақсылап шайқаңдар және индикатор тамызыңдар. |
|
——————————————- ——————————————- ——————————————— —————————————— —————————————— ——————————————- ——————————————- |
|
Магнийді оттекте жануы және жанып болған сынауыққа су құйып ауызын жауып жақсылап шайқаңдар және индикатор тамызыңдар. |
|
|
Қортынды:———————————————————————————————————————————————————————————————————————————————-
Күні « »
№4 практикалық жұмыс «Қатты заттардың ерігіштігіне температураның әсері»
Мақсаты: Булану техникасын қолданып судың 100 г заттың ерігіштігін есептей алу, алынған мәліметтерді анықтамалықтағы мәнмекн салыстыру.
Реактивтер мен құрал-жабдықтар: Калий би хроматының кристалдары, дистилденген су, сағат сшынысы, стақан, термометр, электр плиткасы немесе спирт шам, сіріңке, асбест тор, техникалық таразы, шыны таяқша, жіптің бір сабағы.
Жұмыстың барысы:
|
Орындалу реті |
Не байқалды? |
Қортынды. |
|
Техникалық таразыда 10 г K2 Cr2 O7 тұзын өлшеп алып, стақанға салыңдар. Тұзға 20 мл дистилденген су қосыңдар және оны температурасын өлшеңдер. Стақанды асбест торға қойып тұз толық ерігенше қыздырып, температурасын өлшеңдер. |
|
|
|
Шыны таяқшаға жіпті байлап, оны стақаннның бетіне көлденең қойыңдар, жіп Стақанның ортасында тұруы керек , ертіндіні бөлме температурасына дейін салқындатыңдар. Суығаннан кейін жіпті бақылаңдар. |
|
|
Қортынды:
Ерігіштік дегеніміз не?———————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————-
Қаныққан және қанықпаған ертінді дегеніміз не?———————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————
Күні « »
№5 практикалық жұмыс «Пайыздық және молярлық концентрациялары берілген ерітінділерді дайындау»
Мақсаты: ерітінділер даярлауды білу, өлшеу және есептеуді түсіну, белгілі концентрацияда ерітінді дайындауды қолдану.
Құрал- жабдықтар: 50мл,25 мл, 100 мл көлемдегі стақандар, шыны таяқша, таразы, гирлер,қалақша, өлшегіш цилиндр, өлшемі бар құтылар 25 мл,50 мл,100 мл.
Жұмыстың барысы:
1.Заттың массалық үлесі көрсетілген тұз ерітіндісін дайындау;
1. Заттың массалық үлесі көрсетілген ерітіндіні дайындау үшін тиісті тапсырманы мұғалімнен ал.
2. Есептің шарты бойынша қажетті тұздың массасын және судың көлемін есепте;
3. Таразыға тұзды өлшеп конусты құтыға сал;
4. Дистилденген судың қажетті көлемін ал (сұйықтықтың көлемін өлшеу ереже сін есіңе түсір) және оны конусты құтыдағы тұздың үстіне құй;
5. Конусты құтыдағы тұз ерігенше араластыр;
6. Есепті төменде берілген үлгіде жазып шығар;
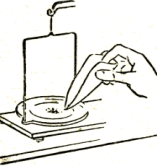

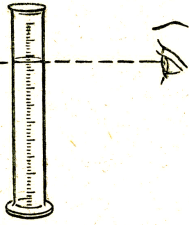

1-есеп. Массалық үлесі 5%-дық ас тұзының 50 грамм ерітіндісін дайында.
2-есеп. Массалық үлесі 5%-дық ас тұзының 25 грамм ерітіндісін дайында.
3-есеп. Массалық үлесі 10%-дық ас тұзының 10грамм ерітіндісін дайында.
Берілгені Шешуі: m(су) = mерітінді·mтұз 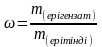 ;
;
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ω(%)=
mерітінді(г)=
Табу керек:
Жауабы:_________
2. Мольдік концентрациясы көрсетілген тұз ерітіндісін дайындау;
1. Мольдік концентрациясы көрсетілген тұз ерітіндісін дайындау үшін тиісті тап сырманы мұғалімнен ал.
2. Заттың мольдік концентрациясы көрсетілген ерітіндіні дайындау үшін тұздың массасын және судың көлемін есепте;
3. Тұздың қажетті массасын өлше және құтыға сал;
4. Құтыға аз ғана су құй, тұзы толық ерігенше араластыр. Содан соң қажетті белгісіне дейін құтыға су құй.
5. Есепті төменде берілген үлгіде жазып шығар;
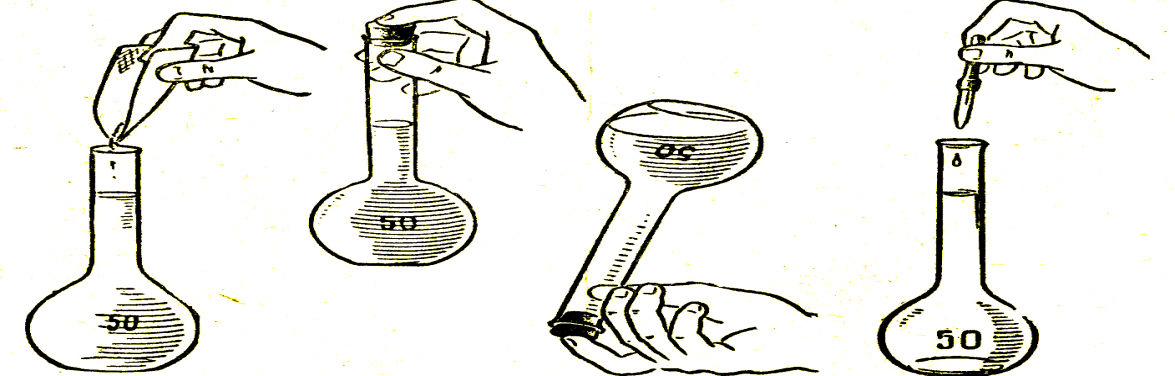
1-есеп. Мольдік концентрациясы 0,2 моль/л 50мл ас содасының ерітіндісін дайында.
2-есеп. Мольдік концентрациясы 0,5 моль/л 50мл ас содасының ерітіндісін дайында.
3-есеп. Мольдік концентрациясы 0,1 моль/л 50мл ас содасының ерітіндісін дайында.
Берілгені: Шешуі: CM = 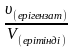 ;
;  ;
; 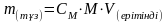
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Vер(мл)=
C(моль/л)=
_______________
Табу керек:
mтұз(г)=?
Жауабы:___________
Қорытынды:
_______________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Күні « »
№ 6 практикалық жұмыс «Көміртектің физикалық және химиялық қасиеттері».
Мақсаты: Көмірді жаққанда моноксид пен диоксидтің түзілу жағдайларын білу.
Реактивтер мен құрал- жабдықтар: активтелген ағаш көмір, мыс оксиді, әк суы, қызыл фуксин, тұрғы, сынауықтар, бүктелген қара қағаз, спирт шамы, сіріңке, сүзгі қағаз, құйғы.
Жұмыстың барысы:
|
Жұмыстың орындалу реті |
Не байқалды? |
Қортынды. |
|
Ағаш көмірдің абсорбциялық мүмкіндігі. Конус тәрізді колбаға кез келген бояуды суға салып ерітіңдер. Ерітіндіге ұнтақталған ағаш көмірді салып, шайқап араластырыңдар. Ертіндіні сүзіп, бояудың түсінің жойылғанын бақылаңдар.
|
|
|
|
Көмірдің тотықсыздандырғыш қасиеті Қағазға мыс оксиді мен ағаш көмірдің ұнтағын бірдей массада араластырыңдар. Қоспаны құрғақ сынауыққа салып, тұрғыға көлденең етіп бекітіңдер. Сынауықты газ жүретін түтікпен жабыңдар, түтіктің ұшын әк суы бар сынауыққа батырып спирт шамымен қыздырыңдар. Не байқалды?
|
|
|
Қортынды:———————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————
Күні « »
№ 7 практикалық жұмыс «Көмірқышқыл газын алу және оның қасиеттерін зерттеу»
Мақсаты: көмірқышқыл газын алу, оның бар екендігін дәлелдеу, қасиеттерімен танысу.
Реактивтер мен құрал-жабдықтар: мәрмәр түйіршігі немесе бор, тұз қышқылы, индикаторлар, газ алуға арналған түтік, шарпы, стақан, мақта, спирт, шыны текше, қысқыш.
Жұмыстың барысы:
|
Жұмыстың орындалу реті |
Не байқалды? |
Қорытынды, реакция теңдеуі |
|
Газ алуға аналған құрылғыға мәрмәр немес бор кесегін салаып, тұз қышқылын құямыз Газ бөлінгенін бақылаймыз. Екі сынауыққа газды толтырамыз, сынауыққа газ толғанын білу үшін шырпы апарамыз оған шынымен бетін жауып қойыңдар. Реакция теңдеуін жаз. |
|
|
|
Бөлініп жатқан газға индикаторды апарамыз, не байқалды? |
|
|
|
Алынған ертіндіні қайнатқанда Қандай өзгеріс болады? |
|
|
|
Құрғақ стақанға спиртке сіңген мақтаны салып, оны жанған шырпымен тұтатыңдыр. Жанып жатқан мақтаға көмірқышқыл газын құйыңдар. |
|
|
|
Магний таспасын қысқышпен ұстап спирт шамына апарып тұтатамызда, газ тоған стақанға саламыз. Магнидің жануын бақылаңдар? |
|
|
|
Рекция өнімдеріне тұз қышқылын ертіндісімен әсер етіңдер, не байқадыңдар? |
|
|
Қортынды:—————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————
«№70 С.Бекбосынов атындағы жалпы орта білім беретін мектеп»
коммуналдық мемлекеттік мекемесі
Сарамандық және зертханалық жұмыс дәптері

8 сынып
оқушысы ____________________
Пән мұғалімі: Асанова А .У