Батыс Қазақстан облысы Теректі ауданы
Абай атындағы жалпы орта білім беретін мектебі
Сабақтың тақырыбы:
«Әрекеттесуші заттардың біреуі артық алынғандағы
химиялық реакциялар теңдеулері бойынша есептер»
Орындаған: Химия пәнінің мұғалімі
Бедеева Лаура Амангелдыевна
Сабақтың тақырыбы: «Әрекеттесуші заттардың біреуі артық алынғандағы химиялық
реакциялар теңдеулері бойынша есептер»
Сабақтың мақсаты:
Білімділік: Оқушыларға химиялық теңдеулер бойынша есептер шығару әдісін түсіндіріп, есептің негізгі типін шешуге әртүрлі әдіс-тәсілдерді пайдаланып, алгоритмдерді қолдануды үйрету. Заттың мольдік массасы, моль түсінігін еске алып, зат массасының сақталу заңын қайталау.
Тәрбиелік: Пәнге деген ынтасын арттыру, өз бетімен жұмыс жасауды, ұқыптылыққа, жүйелілікке, тазалыққа үйрету.
Дамытушылық: Химиялық теңдеулер бойынша есеп шығару дағдыларын дамытып, тереңдете түсу, ой-әрекетін ұйымдастыру.
Сабақтың түрі: Аралас сабақ
Сабақтың өтілу әдістері: Сөздік: түсіндіру, есептер шығару.
Көрнекілік: ерігіштік кесте.
Сабаққа қажетті құралдар: Д.И. Менделеевтің периодтық жүйесі, Н.Н.Бекетовтың «кернеулік қатары», «ерігіштік кесте».
Сабақтың барысы: І. Ұйымдастыру бөлімі
ІІ. Есептер шығару
І. Ұйымдастыру бөлімі.
-
Сәлеметсіздерме, оқушылар!
-
Оқушыларды түгелдеу.
-
Оқушылардың назарын сабаққа аудару.
ІІ. Есептер шығару.
Алгоритм
-
Есептің шартын қысқаша өрнектеу.
-
Реакция теңдеулерін жазып теңестіру.
-
Теңдеу бойынша берілген және есептеп табуға қажетті заттардың сандық сипаттамаларын (ν, Mr, M, m, V) тауып. Теңдіктің астына жазу.
-
Есептің шартына сәйкес заттардың зат мөлшерлерін есептеу.
-
Қай заттың артық берілгенін табу.
-
Аз мөлшерде берілген зат бойынша реакция нәтижесінде түзілген заттың массасын (көлемін, зат мөлшерін) есептеу.
-
Есептің жауабын жазу.
1-есеп. Массасы 20 г мыс сульфаты бар ерітіндісін массасы 8 г натрий гидроксидінің ерітіндісімен араластырғанда қанша мыс гидроксидінің тұнбасы түзіледі?
Шешуі:
1. Екі затты қосқанда жүретін химиялық реакцияның теңдеуін және есептеуге қажетті заттардың мөлшерлерін жазамыз:
1) CuSO4 + 2NaOH = Na2SO4 + Cu(OH)2↓
2) ν, моль 1 2 1
М, г/моль 160 40 98
m, г 160 80 98
ν = 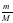 ; ν (CuSO4) =
; ν (CuSO4) =  = 0,125 моль ν (NaOH) =
= 0,125 моль ν (NaOH) =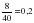 моль
моль
3) Eсептің шартында беріліп тұрған екі заттың мөлшерлерін салыстырамыз:
ν (CuSO4) ν (NaOH)
4) Реакция барысында зат мөлшері аз зат толық жұмсалады. Олай болса, реакция мыс сульфаты бойынша жүреді. Реакция өнімінің зат мөлшері де соған тең болады.
5) Зат мөлшері бойынша түзілген тұнба мыс (II) гидроксидінің массасын табамыз:
m(Cu(OH)2) = ν(Cu(OH)2) * М(Cu(OH)2) = 0,1 моль * 98 г/моль = 9,8 г.
Жауабы: 9,8 г.
2-есеп. Темір (II) сульфидін алу үшін 28 г темір мен 22,4 г күкірт қосылды. Алынған заттардың қайсысы толық әрекеттеседі? Қай зат артық қалады және артық заттың массасы қандай? Темір (II) сульфидінің неше грамы түзілетінін табыңдар.
Шешуі:
-
Реакцияның теңдеуін жазамыз:
Fe + S = FeS
Теңдеу бойынша 1 моль темір мен 1 моль күкіртпен әрекеттесіп, 1 моль темір (II) сульфидін түзеді, яғни
ν (Fe) + ν (S) = ν (FeS)
-
Бастапқы заттардың моль сандарын табамыз:
ν (Fe) =  ;
;
ν (S) = 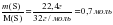 ;
;
ν (Fe) ν (S), яғни күкірт артық алынған.
-
Күкірттің артық мөлшерін:
νарт. (S) = 0,7 – 0,5 = 0,2 моль
және реакцияға түспеген күкірттің массасын анықтаймыз.
m арт. (S) = νарт. (S) * М (S) = 0,2 моль * 32 г/моль = 6,4 г.
-
Реакция нәтижесінде түзілген өнімнің мөлшері реакцияға жеткіліксіз алынған бастапқы зат мөлшерімен анықталады, яғни
ν (FeS) = ν (Fe) = 0,5 моль.
Темір (II) сульфидінің массасын есептейміз:
m (FeS) = ν (FeS) * M (FeS) = 0,5 моль * 88г/моль 44 г.
Жауабы: m арт. (S) = 6,4 г; m (FeS) = 44 г.
3-есеп. 2 л азот пен 4 л сутек әрекеттескенде (қ.ж.) түзілетін аммиактың көлемін табыңдар.
Шешуі:
-
N2 + 3H2 = 2NH3
ν 1 3 2
-
ν =
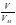 ; ν (N2) =
; ν (N2) = 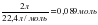 ; ν(H2) =
; ν(H2) =  ;
; -
3 моль H2 әрекеттескенде 2 моль NH3 түзілсе, есептің шарты бойынша:
0,178 моль H2 ——— х моль NH3 түзіледі.
ν (NH3) = 2*

V = ν * VM өрнегін пайдаланып, түзілген аммиактың көлемін табамыз:
V(NH3) = 0,119 моль * 22,4 л/моль = 2,66 л.
4-есеп. Құрамында 7,4 г кальций гидроксиді бар ерітінді арқылы 1,8 л (қ.ж.) көмірқышқыл газы жіберілді. Түзілген тұнбаның массасын табыңдар.
Шешуі:
-
Ca(OH)2 + CO2 = CaCO3↓ + H2O (1)
ν (CO2) ν [Ca(OH)2] артық болса, онда ол тұнбадағы кальций карбонатымен әрекеттесіп еритін тұз – кальций гидрокарбонатын түзеді:
CaCO3 + CO2 + H2O = Са(НСО3)2 (2)
-
Бастапқы заттардың мөлшерлерін есептейміз:
ν[Ca(OH)2] = 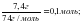
ν(CO2) = 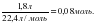
ν [Ca(OH)2] ν(CO2), реакция (1) теңдеу бойынша жүреді. түзілген CaCO3 мөлшері реакцияға жеткіліксіз алынған заттың мөлшерімен анықталады:
ν [Ca(OH)2] = ν(CO2) = 0,08 моль.
-
Түзілген тұнбаның массасы:
m (CaCO3) = 0,08 моль * 100г/моль = 8 г.
Жауабы: m (CaCO3) = 8 г.
5-есеп. Құрамында 2,67 г алюминий хлориді бар ерітіндіге құрамында 2,8 г натрий гидроксиді бар сілті ерітіндісі қосылды. Түзілген алюминий гидроксидінің зат мөлшерін есептеңдер.
Шешуі:
-
AICI3 + 3NaOH = AI(OH)3 + 3 NaCI (1)
-
Реакгенттердің зат мөлшерлерін анықтаймыз:
ν (AICI3) = 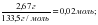
ν (NaOH) = 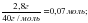
-
Түзілген AI(OH)3 зат мөлшері:
ν [AI(OH)3] = ν (AICI3) = 0,02 моль.
-
Алюминий гидроксидін түзуге жұмсалған NaOH-тың мөлшерін табамыз. 1-теідеу бойынша:
1 моль AICI3-пен 3 моль NaOH әрекеттессе
0,02 моль AICI3 ——— х моль NaOH әрекеттеседі.
х = 0,02 * 3 = 0,06 моль NaOH.
-
Яғни NaOH артық мөлшерде берілген. Оның 1-реакциядан артылатын мөлшерін табамыз:
νарт.(NaOH) = 0,07 моль – 0,06 моль = 0,01 моль.
-
AI(OH)3 екідайлы болғандықтан, NaOH артық мөлшерінде AI(OH)3 ериді. Теңдеуді ықшамдап аламыз:
AI(OH)3 + NaOH = NaAIO2 + 2H2O (2)
2-теңдеу б/ша реакцияға түсіп, еритін AI(OH)3 зат мөлшері:
ν2 [AI(OH)3] = νарт.(NaOH) = 0,01 моль.
-
1-реакция теңдеуі б/ша түзілген 0,02 моль AI(OH)3-тің 0,01 молі 2-реакция б/ша еріп кетеді. Ал қалған AI(OH)3 мөлшері:
ν3 [AI(OH)3] = ν1 [AI(OH)3] = ν2 [AI(OH)3] = 0,02 моль – 0,01 моль = 0,01 моль.
Жауабы: ν3 [AI(OH)3] = 0,01 моль.